立志用所学服务祖国医学事业
2023年末,我非常荣幸获得第十届树兰医学青年奖,这是我科研生涯中的一座重要里程碑。在此,由衷地感谢树森·兰娟院士人才基金和评审委员对我工作的认可。
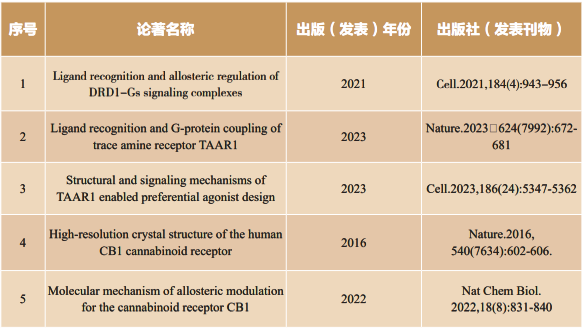
回顾科研历程,我的研究工作主要围绕G蛋白偶联受体(GPCR)创新药物发现展开研究。我与GPCR的故事始于2014年夏天,那一年博士毕业后,在导师施蕴渝院士的推荐和支持下,跨域大洋,前往美国德州大学西南医学中心Daniel Rosenbaum教授实验室开展了博士后研究,踏上了探索GPCR的魅力之旅。GPCR是人体最大的膜受体家族,调控了人体几乎所有生理功能。更令人振奋的是,约有三分之一的临床药物是以GPCR为直接靶标。这让我坚信研究GPCR的结构与功能可以更好为靶向药物发现做出重要突破。然而,GPCR高度动态性特征给研究带来了巨大挑战。博士后期间,Daniel Rosenbaum教授一直鼓励我做最具有挑战性和最前沿的科学研究,经过4年博士后训练,通过大量尝试和摸索,最终建立了稳定GPCR的研究方法,并揭开了大麻素受体CB1的“神秘面纱”,这一突破性发现也发表在Nature杂志上。更有意义的是,该研究方法也被广泛采纳和引用用,助力了300余篇论文的发表。
2018年5月,在四川大学原校长魏于全院士的帮助和指导下,我加入华西医院生物治疗全国重点实验室开展独立研究,立志用所学服务祖国医学事业。科技创新是每一位医学科研工作者的使命,我一直在思考如何以临床需求为导向,发现GPCR创新药物。GPCR亚型众多,信号通路复杂,药物脱靶是临床用药的普遍难题。通过大量的文献调研和研究,我和我的团队发现药物多靶向于GPCR的正构位点,而GPCR亚型之间正构位点保守性高,往往造成药物脱靶副反应。于是,我和团队着手寻找突破口,寻找药物靶向的新位点。我带领团队建立了冷冻电镜结构解析和药理学等技术平台,并基于这些技术平台国际上首次鉴定了大麻素受体、多巴胺受体、脂质受体等多个GPCR的新型可成药位点。更重要的是,靶向新位点展现出更好的疾病治疗潜力,并显著降低了药物脱靶副反应。目前也基于新位点筛选出了一些潜在药物先导化合物,申请了国家专利,期待这些成果未来能够走向临床,为原创性的新药创制做出一点点贡献。
当今,基于新靶标的创新药物研发已成为国家的重大布局,“十四五”医药工业发展规划指出“紧盯新靶点、新机制药物开展研发布局,积极引领创新”,也为我指明了新方向。缺乏有效GPCR靶标是药物开发上的另一难题,GPCR家族有800多个成员,数据显示85%的GPCR仍未成药,有巨大的药物研发潜力。我同样肩负党和国家以及树兰医学青年奖的使命,面向国家新药创制的重大需求,致力于从多维度确认GPCR新靶标。近年来,我们针对尚缺乏配体报道的多个GPCR受体进行了结构和功能表征,理解了新靶标GPCR 的工作机制,并设计出具有高选择性的活性分子,极大释放了新靶标GPCR的成药潜力。2021年,我们也在国际上首次确认了新一代帕金森治疗药物LY3154207的靶标-多巴胺受体DRD1,并揭示了药物分子机制,为疾病的干预提供了新思路,相关成果发表在Cell(2021)期刊上,并被选为封面文章。
在GPCR研究的征途上,我也一直致力于打破药物同质化的困局,以GPCR靶标新机制为创新驱动力。我们团队最近的研究聚焦于TAAR1这一备受瞩目的新型抗精神分裂药物靶标GPCR,挖掘其新的药物识别和信号转导机制。基于其独特的药物结合口袋,我们成功筛选出一些已知药物,它们也能够作用于TAAR1发挥作用,为我们展示了“老药新靶”的潜力。这不仅展现了对传统药物利用的巧妙延伸,更是为创新药物研发提供了崭新的思路。深入研究GPCR信号转导的复杂性是创新药物发现的基石。我们发现不同配体可以引导TAAR1开启不同的信号通路,从而调控多样的病理和生理反应。针对受体的特性,我和合作者成功开发出了治疗精神分裂症的新药物先导化合物,实现了疾病的精准干预,减少了副反应。这些研究成果近期分别刊登在Nature(2023)和Cell(2023)期刊上,为科学界和医药界带来了一场新的观点,为精神分裂症治疗领域开启了崭新篇章。
回首这漫长而坚实的科研历程,我深感科技创新的力量。从建立GPCR研究方法,到发现GPCR新位点、新靶标、新机制,荣获了树兰医学青年奖的肯定和鼓励。在未来,我和团队将更加聚焦于GPCR创新药物的研发,带领团队继续向前奔跑,为祖国医药领域注入更多的创新活力。我和团队将继续努力、不忘初心,面向国家重大需求和人民生命健康。以更多的实际行动回馈社会,服务健康中国建设,推动我国医学事业的发展。