
闫创业研究员在剪接体的结构和功能及前体信使RNA剪接机制的研究中做出了卓越贡献,系统解析了剪接循环中酵母与人源不同状态的剪接体,全面和清晰了展示了前体信使RNA剪接的全过程。此外,还在多项重要膜蛋白的研究中做出重要贡献。主要学术成就和贡献如下:一、酵母剪接体的结构与功能研究解析了第一个来源于裂殖酵母的剪接体高分辨率冷冻电镜结构,首次揭示了剪接体的空间结构和催化活性中心,并系统地解析了酿酒酵母中不同状态的剪接体结构,将剪接体的组装、激活、剪接和解聚整个过程通过结构生物学的手段从原子水平上清楚地揭示出来。该系列研究入选2015年中国高等院校十大进展、2016年中国科学十大进展。二、人源剪接体的结构与功能研究解析了第一个人源剪接体高分辨率结构,并系统地解析了人源剪接体不同状态的高分辨率冷冻电镜结构,为理解高等生物的前体信使RNA剪接过程提供了重要基础。该研究成果入选“2017年细胞出版社中国年度论文”。三、重要膜蛋白的结构与功能研究解析了第一个高分辨率的γ-分泌酶冷冻电镜结构,系统揭示了γ-分泌酶的组装机制;解析了第一个高分辨钙离子通道RyR1的冷冻电镜结构,对肌肉细胞兴奋收缩耦联的机制理解做出了重要贡献。
[心路历程]
我从事的研究属于生物物理--结构生物学方向,从2008年首次进入实验室到现在开展独立研究在结构生物学领域已经12年。经历过晶体学辉煌的时刻也鉴证了冷冻电镜的变革给结构生物学带来的巨大改变。但无论技术如何改变,其实结构生物学的内在本质都是一样的,即从微观角度探索生物大分子的奥秘,追求着结构与功能的统一。2013年电镜革命性的突破使得我们能够通过结构生物学手段研究更加复杂的生物大分子,包括剪接体、光合作用中心、呼吸链复合物等等很多超大复合物,这是结构生物学最激动人心的一个时代。
早期的结构生物学经历
冷冻电镜技术的进步打破了很多对结构生物学研究的限制。在博士期间我还主要通过X-射线晶体学进行结构研究,即通过获得蛋白质的晶体并收集其衍射数据,进一步通过不同的相位破解方法获得蛋白质分子的电子密度图,最终重构出其三维结构。晶体学各方面的局限很多,首先需要拿到高纯度和高表达量的样品,之后还需要筛选大量的条件去寻找可能结晶的条件。拿到晶体后,很多时候晶体衍射并不好,同样需要大量时间去优化。在晶体结构解析的过程中,因为相位缺失,实际上在构建模型上很多时候比冷冻电镜更困难。在这期间处理和分析晶体数据、进行模型搭建和结构分析,培养了我良好的数据处理与分析、结构解析与模型搭建的能力,这些对于我后来迅速进入电镜领域起着至关重要的承接作用。在方法学和思维方式上无论是晶体还是电镜其实都是近似的。在博士四五年级的时候,程亦凡冷教授解析了TRPV1的冻冻电镜结构,在整个结构生物学都引起了巨大的轰动,从那个时候起,我逐渐开始学习冷冻电镜相关知识、样品制备和数据处理,也为后面剪接体的工作做好了充足的准备。
RNA剪接与剪接体
在博士后期间我最重要的研究工作集中在生物大分子机器剪接体的结构和功能以及前体mRNA剪接机制。通过结构生物方法,我们系统解析了酵母和人源剪接体不同状态的结构,揭示了剪接体从组装、激活、剪接和解聚整个剪接循环的分子机制。
那什么是RNA剪接呢?在生命科学领域,一个最重要的问题就是,遗传物质如何转化成执行生命活动的蛋白质,这一过程称为基因的表达,它是自然界所有生命赖以生存的最基本过程。与细菌这些低等原核生物相比,真核生物的基因表达需要一个特殊环节来把基因中“无效”的内含子去除,这一过程叫做RNA剪接。
无论从单细胞、多细胞生物到植物和动物,RNA剪接都至关重要,那为何真核生物会进化出这样一套系统呢?基因中产生多余的内含子,之后还要把它切除掉,其实并不是在做无用功。研究人类基因组和蛋白质组学发现,通过质谱鉴定的蛋白质数目要比人类中的编码基因高5~10倍,人体中95%的蛋白编码基因都会产生多种同源异构体,这样的蛋白质多样性是由“可变剪接”来实现的。通过可变剪接,产生多种功能相近的蛋白质同型异构体。这大大提高了真核生物基因组的信息储存效率,提高了真核生物的适应性。
剪接体是真核细胞中催化pre-mRNA剪接过程的实际执行者,在剪接过程中,剪接体各组分以pre-mRNA分子为中心,按照高度精确的顺序进行逐步组装,依次形成E、A、Pre-B、B、Bact、B*、C、C*、P、ILS等复合物。期间大量的蛋白、核酸分子发生结合和解聚,并发生大规模的结构重组,从而实现识别内含子与外显子的交接位点以及催化内含子的切除与外显子的拼接两方面的功能(图1)。
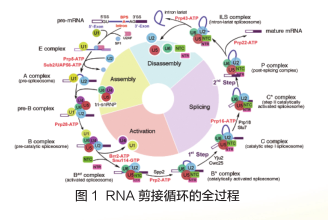
解析第一个剪接体结构
《自然》在 2014 年曾经提出结构生物学面临的两个最有挑战性的难题:剪接体和核孔复合体。剪接体难在太过柔性,而核孔复合体则是太大,在当时都被认为是不可能解析的。
我们在2015年初收集到了高质量的剪接体的单颗粒冷冻电镜数据,初步的计算能够得到比较好的2维分类结果,很快我们将核心分辨率计算到了3.6Å。这让我感到十分意外与激动。在计算的同时,我也马上展开了电镜密度的分析进行模型搭建。由于剪接体的成分十分复杂,在整个过程中有上百个蛋白参与,这给电镜密度的分析造成了很多难度。通过质谱辅助,我们逐步鉴定出了核心区域大部分蛋白。但是由于剪接体高度柔性,周边很多区域的分辨率并不高,使得我们不能够很好地进行模型搭建。同时当时计算资源的限制,整个周边局部区域的计算其实比较缓慢。2015年的计算能力与现在的集群和GPU图像工作站其实差距非常大,可能有近10倍的差距。一个局部区域的优化就需要1周以上的时间,在此期间通过改善整个局部区域密度优化的策略,我们更快地实现了局部区域的优化,从而大大提速了整个结构测定的完成。
在结构搭建的过程中,几乎也是从无到有,从头把剪接体的模型一点点搭建出来的。在结构数据库中,当时并没有来源于我们使用的这个酵母体系S.pombe的任何剪接体相关蛋白晶体结构,需要从头搭建绝大部分蛋白质的结构。在这个过程中,我们也遇到了很多困难,有的蛋白质结构像绳子一样完全是无序的结构,有的蛋白质位于周边,分辨率只能提高到不到4Å,需要反复推理尝试去鉴定它是什么蛋白质。
经过近两个月的不停计算和模型搭建,当我把整个剪接体完整的结构搭建出来的时候,内心非常激动和自豪。在还没有任何人知道剪接体长什么样子的时候,一点点把它搭建出来,并第一个知道了它的全貌,知道了活性位点是如何形成的、内含子是如何被识别的、众多的RNA和蛋白质分子是如何一起执行功能的,这种科研成就感令人激动万分。
2015年8月,我们第一个剪接体的结构在《科学》(Science)上以背靠背的形式发表了两篇长文,报道了首个剪接体高分辨率三维结构,该结构同时也入选当期Science封面。值得骄傲的是,我们的剪接体结构也被受邀入选美国经典生化教材Lehninger编写的《Principles of Biochemistry》第七版封面。
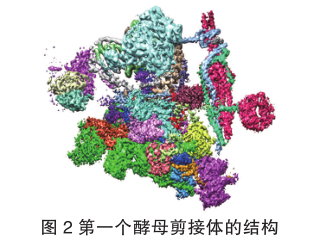
完整剪接循环的剪接体结构解析
在2016年我们又捕获了剪接激活前Bact和完成第一步剪接的C复合物两个关键状态,文章同样以背靠背的形式发表,这项进一步的研究成果入选“2016年中国十大科技进展”。
此后我们系统地解析了酵母和人源不同状态的剪接体结构,包括八个重要的不同状态剪接体结构,分别为pre-B、B、Bact、B*、C、C*、P、ILS复合物。这些结构提供了全面和清晰的剪接体结构信息,进一步揭示了剪接体的组装和工作机理,为理解高等生物的前体mRNA剪接提供了重要基础。
未来研究方向
在开展独立工作之后,我的研究工作将继续围绕结构生物学展开,包括重要膜蛋白复合物的结构与功能以及新的方法的开发。其中在膜蛋白方面我关注一类单羧酸转运蛋白的结构与功能,研究发现它们与肿瘤的发生与发展息息相关。
以乳酸、丙酮酸和酮体为代表的单羧酸是大多数哺乳动物细胞中的必需代谢产物。这些单羧酸代谢物的动态吸收和再分配是由单羧酸转运体MCTs完成的。在14种已鉴定的MCTs中,MCT1-MCT4在多种组织中表达,催化一元羧酸的质子耦合双向传输。科研人员发现,MCT1、2和4在多种癌症中的高表达与癌症的发展有密切关系。由MCT1和其他亚型共同介导的乳酸穿梭能够连接以糖酵解为主要产能方式和以线粒体氧化为主要产能方式(Oxidative tumor cell的癌细胞使其形成协同代谢,从而促进肿瘤的发生与发展(图3)。
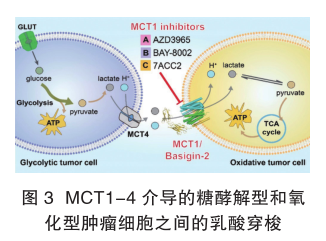
因于其在癌症发生中的重要作用,MCT1被认为是重要的癌症治疗靶点。同时多个以MCT1为靶点的小分子抑制剂也被报道。我们最近的一项研究成果就是通过结构生物学和生物化学相结合的手段阐明了MCT1的转运机理和小分子候选药物的抑制机制,为进一步靶向MCTs的药物发现奠定了基础。这项工作近期在《细胞》杂志上线。在未来,我希望通过这项工作的进一步推进,发展和开发新型的抗癌小分子药物,为未来癌症治疗添砖加瓦。
[代表性著作]
[获奖者风采]

[提名人]
