
[教育和科研经历]
郭国骥(1983.4.12 — ),单细胞分析技术专家。生于湖北省武汉市。2005年本科毕业于武汉大学;2010年博士毕业于新加坡国立大学;后赴美国哈佛大学医学院从事博士后研究工作。2014年回国任浙江大学医学院教授和博士生导师。2015年入选“国家青年千人计划”,2016年获“浙江省杰出青年基金”,2017年获“国家优秀青年基金”。现任浙江大学干细胞与再生医学中心副主任,浙江大学血液学研究所副所长,浙江大学干细胞联盟副主席,是我国单细胞组学领域技术开拓者之一。他在国内率先建立了国产化的高通量单细胞分析平台;并成功绘制了全球首张哺乳动物细胞图谱;填补了我国在高通量单细胞测序领域的空白。以通讯作者身份在Cell,Cell Research,Genome Biology等权威期刊发表多篇学术论文。
[主要学术贡献]
郭国骥教授是我国的国际知名单细胞组学专家,对高通量单细胞分析技术及小鼠细胞图谱绘制这两个重大科学方向做出了突出贡献,极大提升了我国相关领域的国际学术地位。2015年入选“国家青年千人计划”,2016年获“浙江省杰出青年基金”,2017年获“国家优秀青年基金”。目前兼任中国医药生物技术协会基因检测分会委员、中国细胞学会衰老细胞生物学分会委员、中国生理学会血液生理学专业委员会青年委员。主要学术成就和贡献如下:
一、建立高通量单细胞qPCR技术的基本实验方法以及数据分析手段,推动了单细胞水平系统生物学的发展。郭国骥博士首次建立了高通量单细胞qPCR的实验方法及相关生物信息学分析流程,并利用这套技术研究了哺乳动物早期胚胎发育、造血干细胞分化及小分子诱导体细胞转分化的细胞命运决定过程。相关工作分别发表在权威期刊Developmental Cell、Cell Stem Cell和Cell Research上。
二、建立Microwell-seq高通量单细胞测序技术,并绘制世界首个哺乳动物细胞图谱。郭国骥团队自主开发了一套完全国产化的Microwell-seq高通量单细胞测序平台,在提升现有单细胞技术精确度的同时,使得单细胞测序文库的构建成本降低了一个数量级。利用这一世界领先的技术平台,该团队对来自小鼠近50种器官组织的40余万个细胞进行了系统性的单细胞转录组分析,并构建了首个哺乳动物细胞图谱。这项工作于2018年2月以亮点论文的形式发表在著名学术期刊Cell上。该工作为单细胞组学领域里程碑式的研究进展,引起业内巨大反响,人民日报、新华社等媒体对其进行了重点报道。研究成果将对未来正常与疾病细胞的检测、分类和鉴定带来深远影响。
三、首次运用高通量微流控单细胞测序技术解析人多能干细胞早期分化通路。郭国骥团队首次运用高通量微流控芯片来捕获单细胞样品,对人多能干细胞拟胚体分化系统进行了高深度的单细胞转录组测序分析,绘制了人多能干细胞的谱系分化图谱。该工作与2018年四月发表在权威期刊Genome Biology上。
[心路历程]
我出生在湖北武汉。小时候父亲的教导非常严格,三岁半就开始学习书法和背诵诗词。虽然我一直表现出较高的音乐天赋,父亲却反对我玩音乐,希望我能“坐得住”,专心做学问。到后来,他甚至反对我思考一切与学术无关的人生选择。在后来的人生轨迹中,我发现我儿时所接受的教育方式非常必要。事实证明我从来都不缺“创新性的思维”,缺乏的是能够“坐得住”,戒骄戒躁的自制力,和“沉得下心”,完成想法得执行力。我觉得我的情况,在中国不是个例。
本科毕业后我赴新加坡攻读博士学位,当时实验室有很多研究方向可以探索,我却盯上了大家都不太看好的单细胞分析技术。07-08年几乎身边所有的人都认为单细胞分析不可能实现,最后我们用数据证实单细胞分析技术不仅能实现,而且能够稳定的对细胞表达状态进行分类。 我与合作者以及导师一起,建立了单细胞基因表达谱数据分析的基本流程,并研究了哺乳动物发育过程中的第一轮谱系分化过程:从全能的受精卵发育成拥有三种细胞谱系的囊胚。多年来,对于在这一过程中细胞何时最先开始分化的问题,人们一直争论不休。我们对于小鼠着床前发育的精确描述解决了这一问题。这一研究成果于2010年被Cell子刊 Developmental Cell发表,干细胞生物学顶级期刊 Cell Stem Cell的一篇同期评论文章高度评价了这项工作的原创性和重要性。
博士毕业后我来到哈佛大学,导师是血液领域的世界级专家。2010年,主流科学界仍然没有接受单细胞分析技术,但我坚持自己的想法,对整个小鼠的造血体系做了全面的单细胞分析,获得了系统性的单细胞表达谱数据。我和合作者利用单细胞数据的渐变性成功的模拟出造血干细胞的早期分化路径,并修正了经典分化路径中的错误。我们发现传统的共同髓系祖细胞、共同淋系祖细胞和多能性祖细胞都具有极高的异质性,并鉴定出新的细胞表面标志物CD55用来富集血小板偏向的多能性祖细胞。同时,我们将单细胞表达谱数据与转录因子的ChIP-seq数据进行整合,从而构建了造血干细胞初始分化过程中的基因调控网络,解释了原始造血干细胞向血小板世系直接分化的分子机理 (Cell Stem Cell, 2013)。
2014年,我刚刚三十岁便很幸运的被浙江大学医学院聘为教授、博士生导师。那年年底我毫不犹豫的放弃了美国和澳洲的机会,并在浙江大学医学院干细胞与再生医学中心组建了自己的实验室,继续专注单细胞分析技术的开发与应用研究。16年,我们利用基于微流控单细胞mRNA-seq分析,发现血清培养的小鼠ESC存在显著的异质性,并在转录组水平上精确定义了细胞分化的不同阶段。其进一步研究表明,无血清培养可以减少小鼠ESC的异质性和转录组表达差异。该项工作发表在Cell子刊Cell Reports杂志。随后,我们利用优化的高通量微流控芯片C1 HT IFC进一步研究了人多能干细胞早期分化的相关通路。该平台每次可分析多达800个细胞,并且每个细胞能检测到约5000个基因。我们在人多能干细胞分化产生的拟胚体中发现了三胚层多种组织细胞的前体,包括神经,肌肉,内皮,肝脏,上皮组织等。通过时序性分析描绘了这些前体细胞分化过程中动态的基因变化。该研究加深了我们对早期胚胎谱系分化分子通路的了解,并能促进分化方案的优化。这项工作发表在基因组学权威期刊Genome Biology上。
在回国后的几年里,我逐渐意识到一个非常严重的问题,我国的很多科学研究,严重依赖进口的仪器设备,实验试剂成本极其昂贵,科研经费的外流阻碍了我国核心技术的研发产业链。于是,我的团队励精图治,自主开发了一套完全国产化的Microwell-seq高通量单细胞测序平台,在提升现有单细胞技术精确度的同时,使得单细胞测序文库的构建成本降低了一个数量级。利用这一平台,我们对来自小鼠近50种器官组织的40余万个细胞进行了系统性的单细胞转录组分析,并构建了首个哺乳动物细胞图谱。该研究全面的涵盖了哺乳动物体内的各种主要细胞类型,并对每一种器官内的组织细胞亚型,基质细胞亚型,血管内皮细胞亚型,和免疫细胞亚型进行了详细的描述,绘制了一幅精美的“细胞地图”。我们的研究发现来自于不同组织的基质细胞,拥有完全不同的基因表达特征,对组织特异性微环境行使重要的调节作用。同时我们构建了小鼠单细胞转录组数据库以及小鼠细胞图谱网站。该网站不仅拥有互动性的数据展示和基因搜索界面,还提供了强大的单细胞数据比对系统。我们的这项工作于2018年2月以亮点论文的形式发表在顶级期刊Cell上,并引起了广泛关注。
单细胞组学技术日新月异,我们团队也在继续向前奔跑。一方面我们正在优化下一代超高通量的单细胞转录组测序技术,另一方面我们也在开发高通量原位测序技术。同时我们的生信团队正在利用神经网络,探索细胞图谱数据背后的基因调控规律。
回国五年,我学到了很多东西,也重新认识了我们的社会和我们的文化。中国和美国比,在医学创新上还有一定差距。现阶段点的突破不少,但由点到面的引领还需要更多的人才积累和知识积累。我们的国家应该如何对世界医学进步做出与人口数量和经济实力相匹配的贡献?到底是应该学习美国的“自由探索”,还是应该延续发现青蒿素和合成人工牛胰岛素时代的“举国体制”,这是非常值得深思的问题。固步自封和邯郸学步都不可取,我们必须走出自己的道路。
[代表性著作]
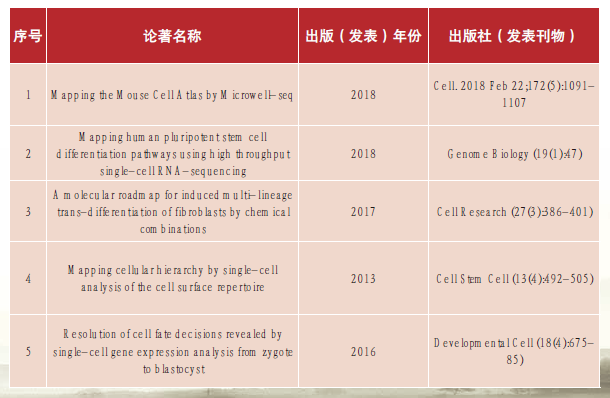
[获奖者风采]

