树兰文化
第十届树兰医学青年奖获奖者:肖百龙教授
2024-04-23

瞄准科学前沿,保持求真务实的科学精神
非常荣幸获得2023年第十届树兰医学奖青年科学奖,这是对我在清华大学的研究团队、合作者以及我个人过去10多年在机械力受体PIEZO研究领域所取得的科研成果的认可。
我于1978年出生在湖南省邵阳市绥宁县偏远山区,通过勤奋求学成长为一名科研工作者,可以说是知识改变命运的幸运者。在乡村小学和绥宁第二中学完成小学和初中的学习后,1994年考取了湖南师范大学附属中学的化学与生物理科实验班,从偏远的山区来到了省会城市长沙,选择了参加生物奥林匹克竞赛。1997保送到中山大学,就读生物化学专业,2001年获得理学学士学位。2001-2006年在加拿大的卡尔加里大学(University of Calgary)攻读博士学位,导师是Wayne Chen教授。2007-2012年在美国The Scripps Research Institute从事神经科学博士后研究,导师为2021年诺贝尔生理学或医学奖得主Ardem Patapoutian教授。2013年入职清华大学,现任清华大学药学院长聘教授、副院长,清华-北大生命科学联合中心高级研究员,新基石研究员,国家杰出青年科学基金获得者,科技创新2030-“脑科学与类脑研究”重大项目首席科学家。
2021年的诺贝尔生理学或医学奖颁发给了美国生理学家David Julius与亚美尼亚裔美国神经科学家Ardem Patapoutian,以表彰他们发现了温度觉和触觉的受体。其中,Patapoutian教授实验室于2010年在《科学》首次发现报导了哺乳动物中的机械力受体PIEZO1与PIEZO2,随后的研究证明其中的PIEZO2介导人体的触觉与本体觉感知。机械力感知这一相对小众化的研究领域随着这一诺奖的颁发得到了广泛的关注。
PIEZO蛋白是一类非常独特的大型膜蛋白,包含2500多个氨基酸,预测有30-40次跨膜螺旋区,是人类蛋白中跨膜次数最多的一类膜蛋白,而且与已知的其他离子通道——例如钙通道、钠通道、钾通道或温度敏感TRP通道(譬如这次获奖的另一主角TRPV1)——没有任何序列上的类似性。因此PIEZO蛋白自身是否形成机械门控阳离子通道有待证明。针对这一科学问题,利用我博士期间开展兰尼碱受体(Ryanodine receptors)的生化结构研究基础,我首次表达纯化了PIEZO1蛋白,证明它形成多聚体,进而通过重组到人工脂膜中,并利用膜片钳电生理记录到阳离子电流,从而证实了PIEZO1是一类全新的感受机械力的离子通道。相关研究结果于2012年发表在《自然》,我是共同第一作者。这是我早期在Ardem实验室参与的工作。
PIEZO这类全新机械门控离子通道家族的发现和确立带来了很多研究契机。一方面,需要证明PIEZO的生理病理功能的重要性,通过在小鼠、果蝇、斑马鱼等模式动物上敲除这个基因,看看会发生什么表型改变。另一方面,PIEZO在分子机制上是怎么工作的?换言之:PIEZO离子通道怎么将机械力刺激转化为为电信号,从而引起触觉、本体觉以及痛觉感知?这是一个核心科学问题。
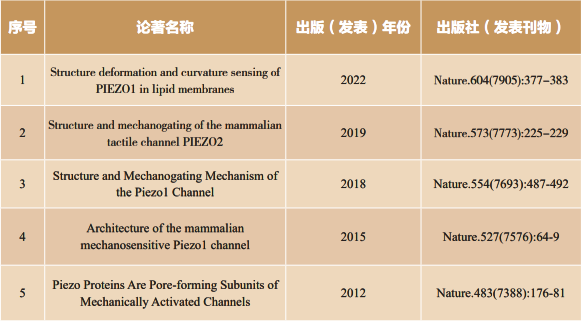
我于2013年在清华大学组建自己的独立课题组,致力于探究哺乳动物包括人类自身如何感知机械力这一生命科学本质问题,聚焦于从分子、细胞、动物及药物水平解答机械力受体PIEZO如何将机械力刺激转化为电化学信号这一核心科学问题,取得了系统性的创新研究成果,具体包括:1)确立了机械力受体PIEZO蛋白是在哺乳动物中发现的首类机械门控阳离子通道的功能属性(Nature 2012;Nature 2015;Neuron 2016);2)揭示了PIEZO将机械力高效转化成生物电信号的结构功能机制,建立了定量解释其皮牛尺度机械敏感性的机械门控理论学说,解答了PIEZO如何将机械刺激转化成生物电化学信号这一核心科学问题(Nature 2018;Nature 2019;Neuron 2020;Nature 2022);3)探究了PIEZO所介导的广泛生理病理功能,鉴定发现了其小分子药物,为相关疾病的治疗提供了新的靶点机制与药物开发策略(eLife 2019; Cell Reports 2019; Nat Commun 2018, 2021; Neuron 2022)。相关研究成果产生了重大学术影响,包括5篇通讯作者论文成果被2021年诺贝尔生理学或医学奖委员会所引用,以及2篇论文成果被收录进经典神经生物学教科书,填补了教科书空白。
我非常幸运全程见证并参与了PIEZO这项诺奖的研究工作,并带领自己年轻的研究团队做出了有影响力的研究成果,同时增强了我们勇于探索科技前沿、攀登科学高峰的信心。随着中国生命医药科学研究的蓬勃发展,我相信只要我们瞄准科学前沿,保持求真务实的科学精神,在中国做出类似诺贝尔奖级别的重大科学发现不再是遥不可及。与从事生命医药科学研究的同仁们共勉!