树兰文化
第十届树兰医学青年奖获奖者:李伟教授
2024-03-23

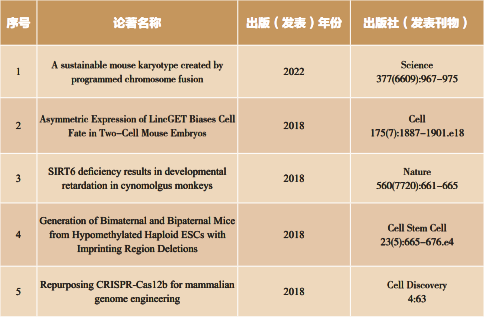
(1)基因工程与干细胞等新技术研发:首次建立Cas12b(Cell Discovery,2018)等系列新型基因编辑工具,部分技术转化产品进入临床;建立异种杂合二倍体胚胎干细胞(Cell,2016)等多种新型干细胞;建立哺乳动物复杂遗传改造和单性生殖新技术(Cell Stem Cell,2018),入选“The Scientist”评选的“Top Technical Advances in 2018",以及Cell出版社2018中国年度论文;建立哺乳动物染色体工程新技术并首次实现完整染色体可编程连接(Science,2022),入选2022年度“中国生命科学十大进展和“中国十大医学科技新闻"。
(2)利用基因工程和干细胞技术解析发育调控新机制:发现小鼠第一次细胞命运决定的关键分子LineGET(Cell,2018),入选2019年度“中国生命科学十大进展”;建立首个Sirt6基因敲除猴并解析其在灵长类发育中的功能(Nature,2018),入选2018年度“中国生命科学十大进展”;发现调控配子发育的重要基因功能与调控机制,包括揭示Mett13介导的m6A修饰调控精子发生(Cell Research,2017),CyclinB3特异性调控卵母细胞减数第一次分裂(Journal of Cell Biology,2019)等。
发展哺乳动物工程生物学 探索再生医学基础与转化
我从 2005 年开始进入周琪老师实验室,学习生物学实验研究,做的第一个课题,就是利用胚胎干细胞和同源重组技术在实验室建立小鼠基因敲除平台,研究 Tex101 等通过质谱技术发现的一批生殖细胞特异表达基因的功能。不像现在可以通过服务机构来制备基因敲除小鼠,当时国内生物技术的基础还比较薄弱,既没有很好的公用实验平台,也缺乏能够提供高质量科研服务的公司,所以需要从头来搭建一些难度稍大的技术平台开展研究。一转眼将近 20 年过去,作为一名研究人员,我见证了iPS细胞、CRISPR基因编辑等颠覆性技术的产生以及它们对生命科学和生物医学带来的变革性发展。我也一直在思考,在如此激动人心的生命科学发展浪潮中,我能够做些什么。当前,如何应对哺乳动物个体发育与调控的复杂性,仍然是一个巨大挑战。基于我们过去在单倍体干细胞、染色体工程、单性生殖技术和小鼠复杂遗传工程改造等生物工程技术的积累,我希望能够以哺乳动物细胞与个体的表型重构为目标,通过开发和汇聚哺乳动物基因工程、蛋白工程、细胞工程和胚胎工程技术,发展哺乳动物工程生物学这一新的使能技术平台;通过在干细胞和早期胚胎等种子细胞中进行大片段DNA写入和多基因时空特异调控等信息输入,以及基于所生成的类器官或个体的表型与功能输出,实现对复杂表型和功能解析的“基于构建的理解(Building life to Understand It)”方式。在此基础上,我们希望对“哺乳动物能否再生,如何再生?”这一问题进行深入探索。我相信当我职业生涯尾声的时刻,再生医学一定会在临床落地惠及患者,成为继抗生素、外科手术和小分子药物等突破之后人类健康保障发展迎来的又一里程碑式突破。因此除了在基础研究端的探索,我也希望能亲身参与其中,在重大疾病的再生疗法与药物开发中贡献力量。以上就是我在过去几年和未来很长一段时间所聚焦的方向。
围绕这个方向,我和同事们一方面致力于基因工程、干细胞、胚胎工程等新技术的开发和构建,并用于解析生殖与再生调控的机理。例如我们首次将CRISPR-Cas12b(又称为C2c1)改造成为基因组编辑工具,实现了在CRISPR底层工具研发方面的突破。与由国外机构首先发明的CRISPR-Cas9和Cas12a(又称为Cpf1)相比,Cas12b具有若干优势与特点:分子量更小;保持活性的温度和pH范围更广,适用于更多应用场景;脱靶效应更小。这些突破并没有仅仅停留在纸面上,它们很快就被多个生物企业授权使用,所构建的基因编辑药物和基因检测试剂盒均已经进入临床转化阶段。我们还探索了哺乳动物染色体工程新技术与染色体人工演化。在漫长的生命进化过程中,染色体会发生重排而导致核型变异。每百万年啮齿类动物就会积累3.2-3.5种染色体重排,而灵长类动物也会积累1.6种染色体重排。这类事件如何在实验室模式动物中进行模拟和研究?我和同事们首次实现了哺乳动物完整染色体的可编程连接,创建出一系列具有19对染色体的全新核型的实验小鼠,在实验室以人工设计的方式实现了自然界中经过数百至数万年才能实现的核型演化事件。该研究发现了染色体长度的限制;揭示了染色体重排对生殖的影响;证实基因组组装的稳健性是染色体演化的重要基础,为哺乳动物染色体结构改造、动物新核型亚种的创造以及染色体结构变异疾病的模拟提供了可行的技术路线,开启了哺乳动物染色体遗传改造的新领域,这一成果也入选2022年度“中国生命科学十大进展”和2022年度“中国十大医学科技新闻”。
另一方面,针对未解决的医学需求,我和合作者们也尝试利用基因编辑和干细胞新技术开展疾病模拟和诊疗的转化研究,完成了若干单基因遗传病的模拟和基因治疗研究。我本来只是专注于基础研究,2016 年开始参与国家重点实验室管理后,越来越多地学习了国家和科学院对我们青年科技工作者提出的要求,要主动响应国家重大需求,利用自己的研究去解决国家经济社会发展和人民生命健康保障中面临的挑战。身边包括周琪老师领衔的很多早已开始从事前沿生物技术临床转化的老师们也鼓励和支持我开展生物医学方面的转化研究。经过思考,我决定先从单基因遗传病入手,利用我们在生物技术创新方面的优势,去开发这些严重缺乏有效药物、75%在儿童期发病并导致患者致畸、致残、致死的严重疾病的疗法和药物。由于单基因遗传病致病的科学机理相对简单,我一开始就希望不单单是做一些简单的实验室探索,而是希望能够重点突破若干中国人群高发的遗传病的临床治疗。经过与临床医生专家的多次学习和研讨,我们第一个选择了结晶样视网膜色素变性病(Bietti crystalline dystrophy, BCD)。它在中国人群中具有显著增高的发病率,然而在西方人群发病率很低,因而与一些西方国家高度关注的“明星遗传病”相比,针对BCD的基础和临床研究都较为匮乏,缺乏高效的动物模型,更缺乏任何有效的治疗方法。我和合作者们通过敲除包含整个致病基因Cyp4v3的完整基因座,构建了Cyp4v3完全缺失的小鼠模型;结合高脂肪饲喂诱导在基因敲除小鼠中成功诱发了眼底结晶和视功能下降等经典BCD疾病表型;在此基础上开展BCD基因治疗研究,首次展现了基因治疗对于BCD的有效性。接下来我们也主动和制药企业合作推动转化,所开发的基因治疗药物已经获得新药临床试验(IND)批准,是全球范围内首个申请新药临床试验的针对BCD的治疗性药物,在北京同仁医院开展的I/II期临床试验中展示了良好的安全性和初步有效性。目前,我和合作者们已经开发了 7 个新型基因与细胞治疗药物进入临床试验阶段。
回首接触生命科学研究以来的近 20 年,我非常有幸遇到了生命科学大发展的浪潮,非常有幸遇到了一批培养我、支持我、并与我合作开展研究的老师、同事和学生们,非常有幸遇到了国家和社会对科技创新前所未有的重视和支持,才得以取得小小的进步。这些感恩之情终将化为动力,支持我在科技创新服务人民的道路上不断努力前行!